sexta-feira, 18 de outubro de 2013
segunda-feira, 9 de setembro de 2013
quinta-feira, 29 de agosto de 2013
"Precisa-se de Matéria Prima para construir um País"
Apesar do artigo abaixo ter sido escrito em 2005 ainda é muito atual e compartilho com vocês.
"Precisa-se de Matéria Prima para construir um País"
Data: 14/11/2005
por, João Ubaldo Ribeiro -
A crença geral anterior era que Collor não servia, bem como Itamar e Fernando Henrique. Agora dizemos que Lula não serve. E o que vier depois de Lula também não servirá para nada..
Por isso estou começando a suspeitar que o problema não está no ladrão corrupto que foi Collor, ou na farsa que é o Lula. O problema está em nós. Nós como POVO. Nós como matéria prima de um país.
Porque pertenço a um país onde a ESPERTEZA" é a moeda que sempre é valorizada, tanto ou mais do que o dólar.
Um país onde ficar rico da noite para o dia é uma virtude mais apreciada do que formar uma família, baseada em valores e respeito aos demais.
Pertenço a um país onde, lamentavelmente, os jornais jamais poderão ser vendidos como em outros países, isto é, pondo umas caixas nas calçadas onde se paga por um só jornal... E SE TIRA UM SÓ JORNAL, DEIXANDO OS DEMAIS ONDE ESTÃO.
Pertenço ao país onde as "EMPRESAS PRIVADAS" são papelarias particulares de seus empregados desonestos, que levam para casa, como se fosse correto, folhas de papel, lápis, canetas, clipes
e tudo o que possa ser útil para o trabalho dos filhos ...e para eles mesmos.
Pertenço a um país onde a gente se sente o máximo porque conseguiu "puxar" a tevê a cabo do vizinho, onde a gente frauda a declaração de imposto de renda para não pagar ou pagar menos impostos.
Pertenço a um país onde a impontualidade é um hábito.
Onde os diretores das empresas não valorizam o capital humano.
Onde há pouco interesse pela ecologia, onde as pessoas atiram lixo nas ruas e depois reclamam do governo por não limpar os esgotos.
Onde pessoas fazem "gatos" para roubar luz e água e nos queixamos de como esses serviços estão caros.
Onde não existe a cultura pela leitura (exemplo maior nosso atual Presidente, que recentemente falou que é "muito chato ter que ler") e não há consciência nem memória política, histórica nem
econômica.
Onde nossos congressistas trabalham dois dias por semana para aprovar projetos e leis que só servem para afundar ao que não tem, encher o saco ao que tem pouco e beneficiar só a alguns.
Pertenço a um país onde as carteiras de motorista e os certificados médicos podem ser "comprados", sem fazer nenhum exame.
Um país onde uma pessoa de idade avançada, ou uma mulher com uma criança nos braços, ou um inválido, fica em pé no ônibus, enquanto a pessoa que está sentada finge que dorme para não dar o lugar.
Um país no qual a prioridade de passagem é para o carro e não para o pedestre. Um país onde fazemos um monte de coisa errada, mas nos esbaldamos em criticar nossos governantes.
Quanto mais analiso os defeitos do Fernando Henrique e do Lula, melhor me sinto como pessoa, apesar de que ainda ontem "molhei" a mão de um guarda de trânsito para não ser multado.
Quanto mais digo o quanto o Dirceu é culpado, melhor sou eu como brasileiro, apesar de ainda hoje de manhã passei para trás um cliente através de uma fraude, o que me ajudou a pagar algumas dívidas.
Não! Não! Não! Já basta!!.
Como "Matéria Prima" de um país, temos muitas coisas boas, mas nos falta muito para sermos os homens e mulheres que nosso país precisa.
Esses defeitos, essa "ESPERTEZA BRASILEIRA" congênita, essa desonestidade em pequena escala, que depois cresce e evolui até converter-se em casos de escândalo, essa falta de qualidade humana, mais do que Collor, Itamar, Fernando Henrique ou Lula, é que é real e honestamente ruim, porque todos eles são brasileiros como nós, ELEITOS POR NÓS. Nascidos aqui, não em outra parte...
Me entristeço.
Porque, ainda que Lula renunciasse hoje mesmo, o próximo presidente que o suceder terá que continuar trabalhando com a mesma matéria prima defeituosa que, como povo, somos nós mesmos.
E não poderá fazer nada...
Não tenho nenhuma garantia de que alguém o possa fazer melhor, mas enquanto alguém não sinalizar um caminho destinado a erradicar primeiro os vícios que temos como povo, ninguém servirá.
Nem serviu Collor, nem serviu Itamar, não serviu Fernando Henrique, e nem serve Lula, nem servirá o que vier.
Qual é a alternativa?
Precisamos de mais um ditador, para que nos faça cumprir a lei com a força e por meio do terror?
Aqui faz falta outra coisa. E enquanto essa "outra coisa" não comece a surgir de baixo para cima, ou de cima para baixo, ou do centro para os lados, ou como queiram, seguiremos igualmente condenados, igualmente estancados....igualmente sacaneados!!!
É muito gostoso ser brasileiro. Mas quando essa brasilinidade autóctone começa a ser um empecilho às nossas possibilidades de desenvolvimento como Nação, aí a coisa muda...
Não esperemos acender uma vela a todos os Santos, a ver se nos mandam um Messias.
Nós temos que mudar, um novo governador com os mesmos brasileiros não poderá fazer nada.
Está muito claro... Somos nós os que temos que mudar.
Sim, creio que isto encaixa muito bem em tudo o que anda nos acontecendo: desculpamos a mediocridade mediante programas de televisão nefastos e francamente tolerantes com o fracasso.
É a indústria da desculpa e da estupidez.
Agora, depois desta mensagem, francamente decidi procurar o responsável, não para castigá-lo, senão para exigir-lhe (sim, exigir-lhe) que melhore seu comportamento e que não se faça de surdo, de
desentendido.
Sim, decidi procurar o responsável e ESTOU SEGURO QUE O ENCONTRAREI QUANDO ME OLHAR NO ESPELHO.
AÍ ESTÁ. NÃO PRECISO PROCURÁ-LO EM OUTRO LADO.
E você, o que pensa?.. MEDITE!
-.João Ubaldo Ribeiro.-
"Precisa-se de Matéria Prima para construir um País"
Data: 14/11/2005
por, João Ubaldo Ribeiro -
A crença geral anterior era que Collor não servia, bem como Itamar e Fernando Henrique. Agora dizemos que Lula não serve. E o que vier depois de Lula também não servirá para nada..
Por isso estou começando a suspeitar que o problema não está no ladrão corrupto que foi Collor, ou na farsa que é o Lula. O problema está em nós. Nós como POVO. Nós como matéria prima de um país.
Porque pertenço a um país onde a ESPERTEZA" é a moeda que sempre é valorizada, tanto ou mais do que o dólar.
Um país onde ficar rico da noite para o dia é uma virtude mais apreciada do que formar uma família, baseada em valores e respeito aos demais.
Pertenço a um país onde, lamentavelmente, os jornais jamais poderão ser vendidos como em outros países, isto é, pondo umas caixas nas calçadas onde se paga por um só jornal... E SE TIRA UM SÓ JORNAL, DEIXANDO OS DEMAIS ONDE ESTÃO.
Pertenço ao país onde as "EMPRESAS PRIVADAS" são papelarias particulares de seus empregados desonestos, que levam para casa, como se fosse correto, folhas de papel, lápis, canetas, clipes
e tudo o que possa ser útil para o trabalho dos filhos ...e para eles mesmos.
Pertenço a um país onde a gente se sente o máximo porque conseguiu "puxar" a tevê a cabo do vizinho, onde a gente frauda a declaração de imposto de renda para não pagar ou pagar menos impostos.
Pertenço a um país onde a impontualidade é um hábito.
Onde os diretores das empresas não valorizam o capital humano.
Onde há pouco interesse pela ecologia, onde as pessoas atiram lixo nas ruas e depois reclamam do governo por não limpar os esgotos.
Onde pessoas fazem "gatos" para roubar luz e água e nos queixamos de como esses serviços estão caros.
Onde não existe a cultura pela leitura (exemplo maior nosso atual Presidente, que recentemente falou que é "muito chato ter que ler") e não há consciência nem memória política, histórica nem
econômica.
Onde nossos congressistas trabalham dois dias por semana para aprovar projetos e leis que só servem para afundar ao que não tem, encher o saco ao que tem pouco e beneficiar só a alguns.
Pertenço a um país onde as carteiras de motorista e os certificados médicos podem ser "comprados", sem fazer nenhum exame.
Um país onde uma pessoa de idade avançada, ou uma mulher com uma criança nos braços, ou um inválido, fica em pé no ônibus, enquanto a pessoa que está sentada finge que dorme para não dar o lugar.
Um país no qual a prioridade de passagem é para o carro e não para o pedestre. Um país onde fazemos um monte de coisa errada, mas nos esbaldamos em criticar nossos governantes.
Quanto mais analiso os defeitos do Fernando Henrique e do Lula, melhor me sinto como pessoa, apesar de que ainda ontem "molhei" a mão de um guarda de trânsito para não ser multado.
Quanto mais digo o quanto o Dirceu é culpado, melhor sou eu como brasileiro, apesar de ainda hoje de manhã passei para trás um cliente através de uma fraude, o que me ajudou a pagar algumas dívidas.
Não! Não! Não! Já basta!!.
Como "Matéria Prima" de um país, temos muitas coisas boas, mas nos falta muito para sermos os homens e mulheres que nosso país precisa.
Esses defeitos, essa "ESPERTEZA BRASILEIRA" congênita, essa desonestidade em pequena escala, que depois cresce e evolui até converter-se em casos de escândalo, essa falta de qualidade humana, mais do que Collor, Itamar, Fernando Henrique ou Lula, é que é real e honestamente ruim, porque todos eles são brasileiros como nós, ELEITOS POR NÓS. Nascidos aqui, não em outra parte...
Me entristeço.
Porque, ainda que Lula renunciasse hoje mesmo, o próximo presidente que o suceder terá que continuar trabalhando com a mesma matéria prima defeituosa que, como povo, somos nós mesmos.
E não poderá fazer nada...
Não tenho nenhuma garantia de que alguém o possa fazer melhor, mas enquanto alguém não sinalizar um caminho destinado a erradicar primeiro os vícios que temos como povo, ninguém servirá.
Nem serviu Collor, nem serviu Itamar, não serviu Fernando Henrique, e nem serve Lula, nem servirá o que vier.
Qual é a alternativa?
Precisamos de mais um ditador, para que nos faça cumprir a lei com a força e por meio do terror?
Aqui faz falta outra coisa. E enquanto essa "outra coisa" não comece a surgir de baixo para cima, ou de cima para baixo, ou do centro para os lados, ou como queiram, seguiremos igualmente condenados, igualmente estancados....igualmente sacaneados!!!
É muito gostoso ser brasileiro. Mas quando essa brasilinidade autóctone começa a ser um empecilho às nossas possibilidades de desenvolvimento como Nação, aí a coisa muda...
Não esperemos acender uma vela a todos os Santos, a ver se nos mandam um Messias.
Nós temos que mudar, um novo governador com os mesmos brasileiros não poderá fazer nada.
Está muito claro... Somos nós os que temos que mudar.
Sim, creio que isto encaixa muito bem em tudo o que anda nos acontecendo: desculpamos a mediocridade mediante programas de televisão nefastos e francamente tolerantes com o fracasso.
É a indústria da desculpa e da estupidez.
Agora, depois desta mensagem, francamente decidi procurar o responsável, não para castigá-lo, senão para exigir-lhe (sim, exigir-lhe) que melhore seu comportamento e que não se faça de surdo, de
desentendido.
Sim, decidi procurar o responsável e ESTOU SEGURO QUE O ENCONTRAREI QUANDO ME OLHAR NO ESPELHO.
AÍ ESTÁ. NÃO PRECISO PROCURÁ-LO EM OUTRO LADO.
E você, o que pensa?.. MEDITE!
-.João Ubaldo Ribeiro.-
sábado, 24 de agosto de 2013
quinta-feira, 15 de agosto de 2013
Número de oxidação e reações de oxi-redução
Seguem alguns links com exercicios para determinação do nox.
http://exercicios.brasilescola.com/quimica/exercicios-sobre-numero-oxidacao-nox.htm
http://www.portalimpacto.com.br/09/material2010/medio_e_vest/docs/vest/qui/f1/aula5_nox.pdf
As reações abaixo são de oxi-redução?
http://exercicios.brasilescola.com/quimica/exercicios-sobre-numero-oxidacao-nox.htm
http://www.portalimpacto.com.br/09/material2010/medio_e_vest/docs/vest/qui/f1/aula5_nox.pdf
As reações abaixo são de oxi-redução?
-
HIO3 + HI --> I2 + H2O
-
K2Cr2O7 + H2O + S --> SO2 + KOH + Cr2O3
-
K2Cr2O7 + H2O2 + H2SO4 --> K2SO4 + Cr2(SO4)3 + H2O + O2
-
K2Cr2O7 + H2S + H3PO4 --> K3PO4 + CrPO4 + H2O + S
-
K2Cr2O7 + HCl --> KCl + CrCl3 + Cl2 + H2O
-
K2Cr2O7 + KI + H2SO4 --> K2SO4 + Cr2(SO4)3 + I2 + H2O
-
K2Cr2O7 + Na2C2O4 + H2SO4 --> K2SO4 + Cr2(SO4)3 + Na2SO4 + H2O + CO2
-
K2Cr2O7 + FeCl2 + HCl --> CrCl3 + KCl + FeCl3 + HCO2
-
KClO3 + H2SO4 --> HClO4 + ClO2 + K2SO4 + H2O
-
KClO3 + Na2SnO2 --> KCl + Na2SnO3
sexta-feira, 9 de agosto de 2013
Exercicios de atomistica
Pessoal,
acessem o site
http://www.profpc.com.br/Exerc%C3%ADcios%20de%20Qu%C3%ADmica/Setor%20Alfa/Alfa%20-%20M%C3%B3dulo%202.pdf
e resolvam os exercícios para a prova.
Bom estudo e bom fim de semana!!
quarta-feira, 5 de junho de 2013
1º Ano -2013 - Evolução dos modelos atomicos
http://www.youtube.com/watch?feature=player_detailpage&v=58xkET9F7MY
segunda-feira, 3 de junho de 2013
2º Ano - 2013 - Exercicios de concentração mol/L
http://www.profpc.com.br/Exerc%C3%ADcios%20de%20Qu%C3%ADmica/Setor%20Gama/Gama%20-%20M%C3%B3dulo%2022.pdf
domingo, 19 de maio de 2013
3º ano - 2013 - Exercicios Nomenclatura Organica
1. Dê o nome dos compostos abaixo, seguindo as regras da IUPAC.
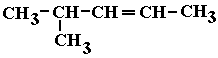


2 -(FUVEST) Dentre as fórmulas abaixo, aquela que representa uma substância utilizada como combustível dissolvente e componentes de bebidas é:
a) b) c)

d) e)

3 (MED. POUSO ALEGRE) O nome sistemático de acordo com a IUPAC para a estrutura
H3C — CH2 — CH — CH — CH2 — OH é:
/ /
CH3 CH3
a) 2,3 - dimetil - 1 - pentanol
b) 2,3 - dimetil pentanol
c) 2 - metil - 3 etil - 1 - butanol
d) 2 - metil - 3 - etil butazona
e) 2,3 dimetil - 3 - etil - 1 propanol
4. (EFOA) De acordo com a IUPAC, qual o nome do composto da fórmula a seguir?

a) 5 - etil - 2 - hexanol
b) 3 - metil - 6 - heptanol
c) 2 - etil - 2 - hexano
d) 5 - metil - 2 - heptanol
e) 2 - cloro - 3 - metil hexano
5 - Escreva afórmula estrutural dos compostos abaixo:
a) 2,2,4-trimetil pentano
b)3-metilbutanal
c)4-metilpentan-2-ona
d)Ácido 2,3,4-trimetil-hexanóico
e) 2 etil - 3-metilpent-1-eno
6 - Classifique a cadeia da molécula 3-metilpent-1-eno:
2 -(FUVEST) Dentre as fórmulas abaixo, aquela que representa uma substância utilizada como combustível dissolvente e componentes de bebidas é:
a) b) c)
d) e)
3 (MED. POUSO ALEGRE) O nome sistemático de acordo com a IUPAC para a estrutura
H3C — CH2 — CH — CH — CH2 — OH é:
/ /
CH3 CH3
a) 2,3 - dimetil - 1 - pentanol
b) 2,3 - dimetil pentanol
c) 2 - metil - 3 etil - 1 - butanol
d) 2 - metil - 3 - etil butazona
e) 2,3 dimetil - 3 - etil - 1 propanol
4. (EFOA) De acordo com a IUPAC, qual o nome do composto da fórmula a seguir?
a) 5 - etil - 2 - hexanol
b) 3 - metil - 6 - heptanol
c) 2 - etil - 2 - hexano
d) 5 - metil - 2 - heptanol
e) 2 - cloro - 3 - metil hexano
5 - Escreva afórmula estrutural dos compostos abaixo:
a) 2,2,4-trimetil pentano
b)3-metilbutanal
c)4-metilpentan-2-ona
d)Ácido 2,3,4-trimetil-hexanóico
e) 2 etil - 3-metilpent-1-eno
6 - Classifique a cadeia da molécula 3-metilpent-1-eno:
a) cíclica, ramificada, saturada, homogênea
b) acíclica, normal, insaturada, heterogênea
c) acíclica, ramificada, insaturada, homogênea
d) acíclica, ramificada, saturada, homogênea.
e) acíclica, ramificada, saturada, homogênea.
quinta-feira, 16 de maio de 2013
2015 - 1º Ano EM - Exercícios de Conservação das massas
1 - De acordo com a Lei de Lavoisier, quando fizermos reagir completamente, em ambiente fechado 1,12 g de ferro com 0,64 g de enxofre, qual a massa, em gramas, de sulfeto de ferro obtida?
2 - Com respeito à equação da reação química abaixo:
carbono + oxigênio --> gás carbonico
12 g x 44 g
y 16 g z
Determine os valores de x, y e z.
3 - Sabemos que 0,50 g de magnésio metálico (Mg) e 0,33 g de oxigênio (O2) reagem completamente, formando exclusivamente óxido de magnésio ( MgO).
a) Que masa de MgO espera-se nesta experiência?
b) Que massa de O2 é necessária para reagir totalmente com 1,0 g de Mg?
c) O que se espera que aconteça se 2,0g de Mg reagirem com 2,0g de O2?
4 - Sabendo-se que a combustão de 60g de carvão requer 128g de gás oxigênio e produz 12g de cinzas, que massa de cinzas é formada quando se queimam 90 g de carvão? Que massa de oxigênio será consumida na combustão dessa massa de carvão?
2 - Com respeito à equação da reação química abaixo:
carbono + oxigênio --> gás carbonico
12 g x 44 g
y 16 g z
Determine os valores de x, y e z.
3 - Sabemos que 0,50 g de magnésio metálico (Mg) e 0,33 g de oxigênio (O2) reagem completamente, formando exclusivamente óxido de magnésio ( MgO).
a) Que masa de MgO espera-se nesta experiência?
b) Que massa de O2 é necessária para reagir totalmente com 1,0 g de Mg?
c) O que se espera que aconteça se 2,0g de Mg reagirem com 2,0g de O2?
4 - Sabendo-se que a combustão de 60g de carvão requer 128g de gás oxigênio e produz 12g de cinzas, que massa de cinzas é formada quando se queimam 90 g de carvão? Que massa de oxigênio será consumida na combustão dessa massa de carvão?
5 - O responsável técnico de um forno de calcinação elaborou
um relatório sobre as três últimas tiragens da produção de cal. O relatório
apresenta a seguinte tabela:
Amostra
|
Massa de calcário (t)
CaCO3
|
Massa de cal (t)
CaO
|
Massa de dióxido de carbono (t) CO2
|
1
|
10,0
|
5,6
|
4,4
|
2
|
11,2
|
||
3
|
12
|
6,7
|
a) Identifique quais são os reagentes e quais são os produtos.
b) Determine os valores que faltam na tabela e complete-a. Mostre os
cálculos realizados.
6 – Em um experimento, soluções aquosas de nitrato de prata, AgNO3, e
de cloreto de sódio, NaCl, reagem entre si e formam cloreto de prata, AgCl,
sólido branco insolúvel e nitrato de sódio, NaNO3, sal solúvel em água.
As massas desses reagentes e de seus produtos estão apresentadas neste
quadro:
AgNO3
|
NaCl
|
AgCl
|
NaNO3
|
1,669 g
|
0,585 g
|
X
|
0,850 g
|
Considere que a reação foi completa e que não há reagentes em excesso.
a) Assim sendo, qual a massa de cloreto de prata produzido?
b) Quais são os reagentes e quem são os produtos?
7 – Dada a seguinte reação de combustão do etanol:
Etanol +
oxigênio --> gás carbônico +
água
Sabe-se que 10 g de etanol reagem com certa massa de oxigênio,
produzindo 19g de gás carbônico e 12 g de água. Qual a massa de oxigênio
necessária para reagir completamente com todo o etanol usado?
8 – A combustão do etanol foi estudada em laboratório e as massas de
reagentes e produtos da combustão de duas amostras desse material foram
registradas em uma tabela.
Massa no estado inicial (g)
|
Massa no estado final (g)
|
||||
Etanol
|
Oxigênio
|
Gás carbônico
|
Água
|
Etanol em excesso
|
Oxigênio em excesso
|
50
|
96
|
88
|
54
|
4
|
|
23
|
50
|
||||
a) Analise a tabela e mostre que a massa se conservou na combustão da
primeira amostra de etanol. Apresente os cálculos e as conclusões
b) Há excesso de oxigênio na combustão da segunda amostra de etanol?
c) Calcule a massa de gás carbônico e água formada na combustão da
segunda amostra de etanol.
terça-feira, 14 de maio de 2013
Concentração de soluções - (g/L e mol/L) - Exercícios
1 - Dissolvem-se 8 g de NaOH em 400 ml de solução. Pede-se
a) Concentração em g/L
b) Concentração em mol/L
(dado : NaOH = 40 g/mol)
R: a) C = 20g/L
b)M = 0,5 mol/L
2 - Dissolvem-se 5,3 g de Na2CO3 em 200 ml de solução. Pede-se
a) Concentração em g/L
b) Concentração em mol/L
(dado : Na2CO3 = 106g/mol)
R : a) C = 26,5g/L
b) M = 0,25 mol/L
3. Soro fisiológico contém 0,900 g de NaCl e a massa molar é igual a 58,5g/mol, em 100 mL de solução aquosa. Qual a concentração do soro fisiológico, expressa em mol/L?
R : M = 0,15 mol/L
4. O ácido fosfórico (H3PO4) é um dos compostos presentes nos refrigerantes, formando uma solução de concentração igual a 0,49 g/L. Qual a concentração em mol/L desta solução? (Massa molar do H3PO4 = 98g/mol)
R : M = 0,005 mol/L ou M = 5mmol/L
5 - Certo suco de caju concentrado contém 25 mg de vitamina C por 50 mL de suco concentrado. Para ser consumido, deve ser diluído com água até que seu volume seja 5 vezes maior que o inicial. Assim, qual a concentração final em g/L da solução?
R : C = 0,1 g/L
6 - O oxalato de cálcio, CaC2O4, é encontrado nas folhas de espinafre, nas sementes de tomate, e é um dos constituintes das pedras formadas nos rins (cálculo renal). Sabendo que 60 mL de uma solução contém 0,1536g de oxalato de cálcio, determine a concentração desse sal em mol/L. (Dados: massa molar em g/mol - Ca = 40; C = 12; O = 16)
R: M = 0,02 mol/L
7 - O teor de vitamina C em uma determinada bebida de soja com sabor morango foi determinado como sendo de 30 mg em uma porção de 200 mL.. Dada a massa molar da vitamina C, 176 g/mol, qual a sua concentração nessa bebida em mol/L?
R: M = 0,85 mmol/L ou M = 0,00085 mol/L
8 - Qual a massa de açúcar ingerida por uma pessoa ao beber um copo de 250 mL de limonada na qual o açúcar está presente na concentração de 80g/L?
R: m = 20 g
9 - Qual é a massa, em gramas, de hidróxido de sódio necessária para se preparar 500 mL de uma solução aquosa 2,0 mol/L? (Dados: H = 1; Na = 23; O = 16).
R: m = 40 g
10 - Qual o volume de água necessário para preparar uma solução de 0,25 mol/L de NaCl, utilizando-se 117 g desse sal? ( Dados Na = 23; Cl = 35,5).
R: V = 8 litros
a) Concentração em g/L
b) Concentração em mol/L
(dado : NaOH = 40 g/mol)
R: a) C = 20g/L
b)M = 0,5 mol/L
2 - Dissolvem-se 5,3 g de Na2CO3 em 200 ml de solução. Pede-se
a) Concentração em g/L
b) Concentração em mol/L
(dado : Na2CO3 = 106g/mol)
R : a) C = 26,5g/L
b) M = 0,25 mol/L
3. Soro fisiológico contém 0,900 g de NaCl e a massa molar é igual a 58,5g/mol, em 100 mL de solução aquosa. Qual a concentração do soro fisiológico, expressa em mol/L?
R : M = 0,15 mol/L
4. O ácido fosfórico (H3PO4) é um dos compostos presentes nos refrigerantes, formando uma solução de concentração igual a 0,49 g/L. Qual a concentração em mol/L desta solução? (Massa molar do H3PO4 = 98g/mol)
R : M = 0,005 mol/L ou M = 5mmol/L
5 - Certo suco de caju concentrado contém 25 mg de vitamina C por 50 mL de suco concentrado. Para ser consumido, deve ser diluído com água até que seu volume seja 5 vezes maior que o inicial. Assim, qual a concentração final em g/L da solução?
R : C = 0,1 g/L
6 - O oxalato de cálcio, CaC2O4, é encontrado nas folhas de espinafre, nas sementes de tomate, e é um dos constituintes das pedras formadas nos rins (cálculo renal). Sabendo que 60 mL de uma solução contém 0,1536g de oxalato de cálcio, determine a concentração desse sal em mol/L. (Dados: massa molar em g/mol - Ca = 40; C = 12; O = 16)
R: M = 0,02 mol/L
7 - O teor de vitamina C em uma determinada bebida de soja com sabor morango foi determinado como sendo de 30 mg em uma porção de 200 mL.. Dada a massa molar da vitamina C, 176 g/mol, qual a sua concentração nessa bebida em mol/L?
R: M = 0,85 mmol/L ou M = 0,00085 mol/L
8 - Qual a massa de açúcar ingerida por uma pessoa ao beber um copo de 250 mL de limonada na qual o açúcar está presente na concentração de 80g/L?
R: m = 20 g
9 - Qual é a massa, em gramas, de hidróxido de sódio necessária para se preparar 500 mL de uma solução aquosa 2,0 mol/L? (Dados: H = 1; Na = 23; O = 16).
R: m = 40 g
10 - Qual o volume de água necessário para preparar uma solução de 0,25 mol/L de NaCl, utilizando-se 117 g desse sal? ( Dados Na = 23; Cl = 35,5).
R: V = 8 litros
quarta-feira, 13 de março de 2013
domingo, 3 de março de 2013
2013 - Exercicios cálculos estequiométricos - 2º Ano
1. (FUVEST) – O alumínio é obtido pela
eletrólise da bauxita. Nessa eletrólise, ocorre a formação de oxigênio que
reage com um dos eletrodos de carbono utilizados no processo. A equação não
balanceada que representa o processo global é:
Al2O3 + C → CO2 + Al Para dois mols de Al2O3,
quantos mols de CO2 e de Al, respectivamente, são produzidos nesse processo?
2. (VUNESP) – Por ocasião das comemorações
oficiais dos quinhentos anos do descobrimento do Brasil, o Banco Central lançou
uma série de moedas comemorativas em ouro e prata. Uma delas, cujo valor facial
é de R$ 20,00, foi cunhada com 8,00 g de “ouro 900”, uma liga metálica que
contém 90% em massa de ouro. Conhecendo o número de Avogadro – NA = 6,0 · 1023
– e sabendo que a massa molar do ouro é 197 g/mol, determine a massa de ouro
presente numa dessas moedas.
3. (FUVEST) – Pela sequência de reações:
C + O2 → CO2
CO2 + NaOH → NaHCO3
qual a massa de hidrogenocarbonato de sódio (NaHCO3)
que se pode obter a partir de 1,00 g de carbono?
(Dadas as massas molares em g/mol: H = 1; C = 12;O =
16; Na = 23)
4. (VUNESP) – O clorato de potássio (KClO3)
pode ser utilizado para a produção de oxigênio (O2) em laboratório.
Quando aquecido na presença de um catalisador, o clorato se decompõe
produzindo, além do gás desejado, cloreto de potássio (KCl).Determine o
volume de oxigênio, medido nas CNTP,produzido quando um mol do clorato de
potássio é consumido.(Dado: volume molar dos gases nas CNTP = 22,4L/mol).
5. (FUVEST) – Quantos mols de hidrogênio se
obtêm por eletrólise de 108 g de água?
Eletrólise da água: H2O → H2 +
½ O2
(Dado: massa molar da água = 18 g/mol)
6. (UNICAMP) – A equação a seguir representa a
obtenção de ferro pela reação de hematita com carvão:
Fe2O3 + 3 C → 2 Fe + 3 CO
(Dados: Massa molar do Fe2O3 =
160 g/mol; Massa molar do Fe = 56 g/mol)
a) Quantos quilogramas de hematita são necessários
para produzir 1120 kg de Fe?
b) Calcule, em condições ambientes, quantos litros
de CO são obtidos por mol de Fe produzido.
(Dado: volume
molar nas condições ambientes = 24 L/mol).
7. (FUVEST) – Nas estações de tratamento de
água, eliminam-se as impurezas sólidas em suspensão através do arraste por
flóculos de hidróxido de alumínio, produzidos na reação representada por:
Al2(SO4)3 + 3
Ca(OH)2 → 2 Al(OH)3 + 3 CaSO4
Para tratar 1,0 ∙ 106 m3 de água foram
adicionadas 17 toneladas de Al2(SO4)3. Qual a
massa de Ca(OH)2
necessária para reagir completamente com esse sal?
(Dadas as massas molares: Al2(SO4)3 = 342
g/mol;
Ca(OH)2 = 74 g/mol)
8. (FUVEST) – Considere a transformação de
ozônio em oxigênio comum representada pela equação:
2 O3 → 3 O2
Determine a massa de oxigênio produzida quando 96 g
de ozônio se transformam completamente.
(Dada a massa atômica: O = 16 u)
9. (VUNESP) – Na fabricação de chapas para circuitos
eletrônicos, uma superfície foi recoberta por uma camada de ouro, por meio de
deposição a vácuo. Sabendo que para recobrir esta chapa foram necessários 2 x
1020 átomos de ouro, determine o custo do ouro usado nesta etapa do
processo de fabricação.
(Dados: massa
molar do ouro = 197 g/mol; 1 g de ouro = R$ 17,00).
10. (VUNESP) – Como o dióxido de carbono, o metano (CH4)
exerce também um efeito estufa na atmosfera. Uma das principais fontes desse
gás provém do cultivo de arroz irrigado por inundação. Segundo a Embrapa,
estima-se que esse tipo de cultura, no Brasil, seja responsável pela emissão de
cerca de 288 Gg (1 Gg = 1 × 109 gramas) de metano por ano. Calcule o
número de moléculas de metano correspondente.
(Dadas as massas molares
em g/mol: H = 1 e C =12).
11. (UNICAMP) – Na metalurgia do zinco, uma das etapas
é a reação do óxido de zinco (ZnO) com monóxido de carbono (CO), produzindo
zinco metálico (Zn) e dióxido de carbono (CO2).
(Dadas as
massas molares em g/mol: Zn = 65,5; O = 16).
a) Escreva a
equação química correspondente.
b) Para cada
1000 g de óxido de zinco que reage, qual a massa de Zn obtida?
12. (FUVEST) – A produção de carboidratos (fórmula mínima
CH2O) pelas plantas verdes obedece à equação geral da fotossíntese: CO2
+ H2O → CH2O + O2 Quantos litros de gás carbônico,
medido nas CNTP, serão necessários para produzir 10 g de carboidrato? (Dado:
volume molar dos gases nas CNTP = 22,4 L/mol; massa molar do CH2O =
30 g/mol)
13. (UNICAMP) – Os sistemas de comunicação e transporte
criados pelo homem foram evoluindo ao longo do tempo. Assim, em fins do século
XVIII, apareceram os balões, cujo desenvolvimento ocorreu durante todo o século
XIX, chegando ao século XX com os dirigíveis cheios de hidrogênio e, mais
recentemente, de hélio. Nesse processo, o
brasileiro
Santos Dumont contribuiu de modo significativo. Os “Zeppelins”, dirigíveis
cheios de hidrogênio, estão, ainda, entre as maiores naves aéreas já
construídas pelo homem. O mais famoso deles, o Hindemburg, começou a sua
história em 1936, terminando em maio de 1937, num dos maiores acidentes aéreos
já vistos e filmados. O seu tamanho era incrível, tendo cerca de 250 metros de comprimento,
com um volume de 200 × 106 litros, correspondendo a 8,1 × 106
mol de gás. Se o hidrogênio (H2) necessário para encher totalmente o
Hindemburg fosse obtido a partir da reação de ferro (Fe) com HCl, dando
FeCl2, quantos quilogramas de ferro seriam necessários?
(Dado: Massa molar do Fe
= 56 g/mol).
14. (UNICAMP)
– Antiácido é um produto farmacêutico utilizado para reduzir acidez
estomacal provocada pelo excesso de ácido clorídrico, HCl. Esse produto
farmacêutico pode ser preparado à base de bicarbonato de sódio, NaHCO3, que
reage com o ácido clorídrico conforme a equação:
HCl + NaHCO3
→ NaCl + H2O + CO2
Considerando que uma dose
do antiácido contém 2,52 g de bicarbonato de sódio, calcule o número de mols de
ácido neutralizados no estômago. (Dado: Massa molar do NaHCO3 = 84
g/mol).
15.
(UNICAMP) – De acordo com a revista Veja, de 01/05/1991, a
Petrobrás havia anunciado que reduziria de 5% para 3% o teor de enxofre no óleo
combustível. Isso significa cerca de 272 toneladas de enxofre a menos, por dia,
na atmosfera. Sabe-se que o enxofre contido no óleo é, na realidade,
transformado em SO2 (um gás) no momento da queima (combustão)
conforme a equação:
S + O2 → SO2
Qual a massa, em
toneladas, deste gás que deixará de ser lançada na atmosfera, por dia, devido à
melhoria anunciada? (Dado: Massas atômicas: S = 32 u; O = 16 u).
16.
(UNICAMP) – Um medicamento contém 90 mg de ácido
acetilssalicílico (C9H8O4) por comprimido.
Quantas moléculas dessa substância há em cada comprimido? (Dado: Massa molar do
C9H8O4 = 180 g/mol).
17. (FUVEST) – Uma das maneiras de
impedir que o SO2, um dos responsáveis pela “chuva ácida”, seja
liberado para a atmosfera é tratá-lo previamente com óxido de magnésio, em
presença de ar, como equacionado a seguir:
MgO(s) + SO2
(g) + ½ O2 (g) → MgSO4 (s)
Quantas toneladas de
óxido de magnésio são consumidas no tratamento de 9,6 ∙ 103
toneladas de SO2?
(Dadas as massas molares
em g/mol: SO2 = 64;MgO = 40)
18. (FUVEST)
– Linus Pauling, prêmio Nobel de Química e da Paz, faleceu recentemente
aos 93 anos. Era um ferrenho defensor das propriedades terapêuticas da vitamina
C. Ingeria diariamente cerca de 2,1 ∙ 10-2 mol dessa vitamina.
Quantas vezes, aproximadamente, a dose ingerida por Pauling é maior que a
recomendada?
(Dado: dose diária
recomendada de vitamina C (C6H8O6)
= 62 mg; massa molar da vitamina C = 176g/mol)
19. (FUVEST)
– Qual a quantidade máxima de carbonato de cálcio (CaCO3), em gramas, que
pode ser preparada a partir da mistura de 2 mols de carbonato de sódio (Na2CO3)
e 3 mols de cloreto de cálcio (CaCl2)?
Obs.: nessa reação também
há a formação de NaCl. (Dados: massa molar do CaCO3 = 100 g/mol).
20.
(FUVEST) – Calcário é uma rocha que contém carbonato de
cálcio, CaCO3. Quantos quilogramas de cal virgem, CaO, podem ser
preparados por pirólise (decomposição térmica) de uma tonelada de calcário
contendo 94,6 % de CaCO3?
CaCO3 → CaO +
CO2
(Dadas as massas molares
em g/mol: CaCO3 = 100; CaO = 56).
Assinar:
Postagens (Atom)






